2024年第一季度,根据国家药品监督管理局药品审评中心(CDE)公示,共34个创新药首次提交上市申请(NDA/BLA),其中涵盖化学药物17种,抗体药物5种,疫苗2种,多肽药物1种,生长激素类生物制品2种,中成药7种。这些潜力药物有望于未来一段时间在国内获批并影响整个市场格局。
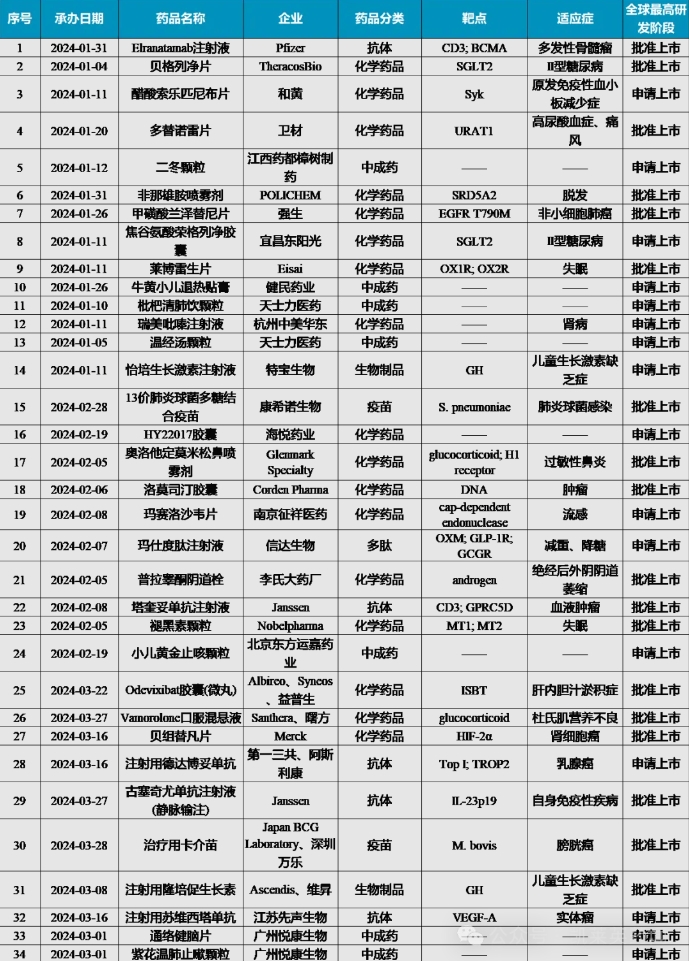
一、化学药物
1、TheracosBio:贝格列净片
作用机制:SGLT2抑制剂
适应症:II型糖尿病
贝格列净(bexagliflozin)是一种钠-葡萄糖协同转运蛋白2(SGLT2)抑制剂,于2022年12月首次获批用于治疗猫糖尿病,于2023年1月获FDA批准用于人2型糖尿病患者的血糖控制。公司评估了bexagliflozin作为单一疗法与二甲双胍联合,以及与格列美脲和西格列汀相比,作为二甲双胍附加疗法的疗效和安全性。结果表明,与安慰剂相比,bexagliflozin治疗可显着降低血红蛋白A1c。观察到bexagliflozin的疗效不劣于格列美脲(滴定至最大剂量6mg)和西格列汀每天一次100mg。报告的最常见不良反应是女性生殖器真菌感染、尿路感染和排尿增加。
2、和黄医药:醋酸索乐匹尼布片
作用机制:Syk抑制剂
适应症:原发免疫性血小板减少症
索乐匹尼布是一种开发用于治疗血液恶性肿瘤和自身免疫性疾病的新型、高选择性的口服脾酪氨酸激酶(Syk)抑制剂,每日一次口服用药。Syk作为B细胞受体和Fc受体信号传导通路中的一个关键蛋白,是多种亚型的B细胞淋巴瘤及自身免疫疾病的成熟治疗靶点。ESLIM-01是一项索乐匹尼布在中国开展的随机、双盲、安慰剂对照的III期临床试验,共纳入188名既往接受过至少一种治疗的慢性成人原发免疫性血小板减少症患者。2023年8月,和黄医药宣布该研究成功达到了其主要终点,即与接受安慰剂治疗的患者相比,接受索乐匹尼布治疗的患者的持续应答率取得了具有临床意义和统计学意义的显著改善,包括总体应答率和安全性在内的所有次要终点。
3、卫材:多替诺雷片
作用机制:URAT1选择性抑制剂
适应症:高尿酸血症和痛风
多替诺雷(Dotinurad)是一款促尿酸排泄药,通过选择性抑制与肾脏中尿酸重吸收有关的尿酸盐转运蛋白(URAT1),抑制尿酸重吸收并降低血尿酸水平;作为一种URAT1选择性抑制剂,多替诺雷有效抑制肾近端小管URAT1而不影响尿酸排泄因子ABCG2和OAT1/3的功能,相比非选择性URAT1抑制剂降血尿酸的效率更高。此前,该药物已经于2020年在日本上市,用于治疗高尿酸血症和痛风。
本次NDA根据在中国开展了一项旨在评估多替诺雷和非布司他治疗痛风疗效的3期临床研究该研究纳入451例痛风患者,随机分为多替诺雷4mg组和非布司他40mg组,主要研究终点是治疗24周血尿酸水平≤6.0 mg/dL的患者百分比。此前,在日本开展的一项3期临床研究结果显示,多替诺雷4mg治疗伴或不伴痛风的高尿酸血症患者,58周血尿酸水平≤6mg的患者比例为100%,长期使用对肾功能无明显影响,对肝功能无临床相关影响。
4、科笛生物:非那雄胺喷雾剂
作用机制:SRD5A2抑制剂
适应症:雄激素性脱发
非那雄胺喷雾剂(CU-40102)是特异性Ⅱ型5α-还原酶竞争抑制剂,通过抑制头皮中睾酮转化为双氢睾酮,可治疗男性患者的雄激素性脱发;它是全球首个亦是唯一一个获批用于雄激素性脱发治疗的外用非那雄胺产品,也是中国首个申报上市的外用非那雄胺产品。与口服非那雄胺不同,CU-40102的外用制剂便于患者将药物直接精确地涂抹在头皮表面,在用药部位保持高浓度,减少药物的全身暴露,从而可减少口服药常会引起的副作用。
该药物在中国注册性临床试验是一项多中心、随机、双盲、安慰剂对照的试验,评估了该产品对中国成年男性雄激素性脱发患者的疗效及安全性。该临床试验共入组270名中国成年男性雄激素性脱发受试者。受试者在24周的持续治疗期内每天在头皮局部外用给药一次。该临床试验结果显示,
在疗效方面,受试者在治疗24周后,CU-40102组受试者的顶部秃发目标区域内的总毛发计数及终毛计数改善均显著优于安慰剂组,差异具有统计学意义(P<0.05),达到主要终点指标和主要的次要终点指标,且疗效从第12周起开始展现。此外,基于研究者评估的顶部毛发评分的有效率,24周治疗后CU-40102组显著优于安慰剂组,且差异具有统计学意义。
在安全性方面,CU-40102受试者对给药部位局部耐受性良好,与安慰剂组不良事件的总体发生率相似,没有发生严重不良事件(TESAE),及没有导致死亡的不良事件(TEAE)。
5、强生:甲磺酸兰泽替尼片
作用机制:EGFR T790M抑制剂
适应症:非小细胞肺癌
兰泽替尼(lazertinib)是第三代EGFR酪氨酸激酶抑制剂(EGFR-TK),该药物最早由Yuhan(柳韩洋行)研发,韩国之外的权益已转让给美国强生旗下的杨森制药。Lazertinib在具有激活EGFR突变、T790M突变和中枢神经系统(CNS)疾病的非小细胞肺癌患者中具有强活性。2021年1月18日,韩国食品药品管理局(MFDS)批准Lazertinib用于既往接受过EGFR-TKI治疗的EGFR T790M突变阳性局部晚期或转移性非小细胞肺癌患者的治疗。
在一项全球性双盲试验,随机分配有EGFR-TKI一线治疗资格的初治、EGFR突变的局部晚期或转移性非小细胞肺癌成年患者接受拉泽替尼(n=196)或吉非替尼(n=197)治疗。主要终点是研究者根据RECIST 1.1标准评估的无进展生存期(PFS)。次要终点包括总生存期(OS)、客观缓解率(ORR)、反应持续时间(DOR)、疾病控制率(DCR)和安全性。数据截至2022年7月29日,拉泽替尼治疗组VS吉非替尼治疗组的中位无进展生存期(PFS)为20.6个月VS 9.7个月(HR为0.45;95%,置信区间:0.34-0.58;P<.001)。总体客观缓解率(ORR)为76.0%VS 76.1%。其中,大部分是部分缓解(PR),分别有2例和1例患者经历了完全缓解(CR);此外,拉泽替尼治疗组VS吉非替尼治疗组的中位反应持续时间(DOR)为19.4个月VS 8.3个月;疾病控制率(DCR)均为93.9%。在数据截止时,总生存期(OS)数据尚不成熟;然而,估计18个月的OS率为80.3%VS 72.4%,24个月的OS率为66.4%VS 58.4%。该试验的安全性数据显示,在拉泽替尼治疗组中,见的任何级别治疗相关不良反应包括:感觉异常(39%)、皮疹(36%)、瘙痒(27%)、甲沟炎(18%)和皮肤干燥(15%);在吉非替尼治疗组中,常见的任何级别治疗相关不良反应包括:腹泻(39%)、皮疹(37%)、丙氨酸转氨酶升高(30%)和天冬氨酸转氨酶升高(26%)。
6、东阳光:焦谷氨酸荣格列净胶囊
作用机制:SGLT2抑制剂
适应症:II型糖尿病
荣格列净是一种SGLT2抑制剂,用于2型糖尿病的治疗,其可通过减少肾脏葡萄糖重吸收、降低肾糖阈,从而增加尿糖排泄,降低血糖。目前国内已上市的SGLT2抑制剂包括恩格列净片、达格列净片、卡格列净片、艾托格列净片、脯氨酸恒格列净片等。针对糖尿病领域,东阳光药已有4款小分子创新药处于获批临床及以上阶段,包括焦谷氨酸荣格列净胶囊、HEC88473注射液、HEC73077片、HEC192334片。
7、卫材:莱博雷生片
作用机制:食欲素受体拮抗剂
适应症:失眠
莱博雷生(lemborexant,商品名:DAYVIGO)是一款双重食欲素受体拮抗剂,通过竞争性结合两种食欲素受体亚型(OX1R和OX2R),抑制食欲素神经传递,调节睡眠-觉醒节律。目前,莱博雷生已在已在日本、美国和中国香港等地获批。该药物的获批是基于两个关键3期临床研究(SUNRISE 1和SUNRISE 2)的结果。SUNRISE 1研究为期一个月,受试者为符合精神疾病诊断与统计手册-第5版(DSM-5)失眠障碍诊断标准的55岁及以上成年女性、65岁及以上成年男性。SUNRISE 2是一项为期6个月的临床研究,研究受试者为18岁及以上符合DSM-5失眠障碍诊断标准的患者。两项研究的分析均表明,莱博雷生不会导致反跳性失眠,亦没有证据显示停药后会产生戒断效应,这表明服药达一年不会产生躯体依赖。
8、华东医药:瑞美吡嗪注射液
作用机制:——
适应症:肾脏疾病
瑞美吡嗪注射液及肾小球滤过率动态监测系统(简称“动态监测系统”)最初由美国MediBeacon开发,华东医药于2019年获得MediBeacon公司全部产品(含后续开发新产品)在中国大陆、香港、台湾、新加坡、马来西亚在内的25个亚洲国家或地区的独家商业化权利。MediBeacon为全球首创医疗器械产品,可通过无创监测外源性示踪剂发出的荧光随时间的变化,实现实时、动态、连续的床旁GFR监测,突破了现有GFR检测方法的时间和空间限制。瑞美吡嗪注射液作为荧光示踪剂与动态监测系统配合使用,以测量肾功能受损或正常患者的肾小球滤过率。
9、征祥医药:玛赛洛沙韦片
作用机制:PA核酸内切酶抑制剂
适应症:单纯性流感
玛赛洛沙韦(ZX-7101A)是新一代聚合酶酸性蛋白(PA)核酸内切酶抑制剂,具有广谱抗流感病毒的特性。2023年8月,征祥医药宣布已与济川药业达成独家合作协议,双方将围绕用于治疗或预防流感的玛赛洛沙韦片开展从产品研发、注册、生产、推广、到渠道管理及商业销售的全流程合作。在本次合作中,济川药业全资子公司将向征祥医药支付不超过人民币1.2亿元的推广权益对价,并拟以自有资金6000万元向征祥医药进行股权投资。
本次申报上市是基于一项多中心、随机、双盲、安慰剂对照2/3期无缝衔接的适应性试验,旨在评估玛赛洛沙韦对比安慰剂在成人无并发症的单纯性流感受试者中的安全性和有效性。结果显示,研究达到主要疗效终点,玛赛洛沙韦给药组“所有流感症状缓解时间”较对照组显著缩短,具有统计学差异;流感病毒(RNA)转阴时间、流感病毒(滴度)转阴时间以及发热缓解时间等次要终点指标也较对照组有显著缩短,具有统计学差异;安全性方面,玛赛洛沙韦的安全耐受性优异,给药组不良反应发生率与对照组相当,无明显的胃肠道不良反应。
10、Syneos/益普生:Odevixibat胶囊(微丸)
作用机制:IBAT抑制剂
适应症:肝内胆汁淤积症
Odevixibat(奥维昔巴特)是一种首创、强效选择性、非系统性、回肠胆汁酸转运体(IBAT)抑制剂,是美国FDA和欧盟EMA批准的第一个用于治疗胆汁淤积症(PFIC)的药物,具有最小的全身暴露并在肠道内局部发挥作用。该药物以每日一次以胶囊形式服用,可以阻断肠胆汁酸经过肠肝循环回流入肝,从而减轻肝脏内及循环内的胆汁酸浓度;此外,该产品只在小肠局部起作用,从而减少了药物的全身暴露。PFIC是一组常染色体隐性遗传性疾病;因基因突变导致胆汁排泌障碍,发生肝内胆汁淤积,最终可发展为肝衰竭。
该药物的全球3期临床研究结果显示:与安慰剂相比,odevixibat奥维昔巴特显著降低了胆汁酸(SBA,p=0.003)、显著改善了皮肤瘙痒(p=0.004),腹泻率仅为个位数。此外,来自PEDFIC-2(开放标签3期扩展研究)的长期数据显示,在治疗长达48周的患者中,血清胆汁酸(sBA)持续和持久地减少、瘙痒评估得到改善、肝脏和生长功能指标令人鼓舞,且odevixibat的耐受性良好。
11、Santhera/曙方:Vamorolone口服混悬液
作用机制:glucocorticoid类似物
适应症:杜氏肌营养不良
Vamorolone是非泼尼松龙衍生物的类固醇药物,是首个在美国和欧盟均获完全批准的DMD治疗药物,其与糖皮质激素结合的受体相同但改变了其下游活性,和传统皮质类固醇药物治疗相比不仅疗效相当而且在维持正常骨代谢、骨密度和生长方面更具有重要的临床安全性优势。
在关键临床试验VISION-DMD中,与安慰剂相比,vamorolone组在治疗24周后达到主要终点:由卧位至站立所需时间(TTSTAND)与安慰剂组相比差异有统计学意义(p=0.002)。同时,vamorolone表现出良好的安全性和耐受性。与安慰剂组相比,最常见的不良事件是库欣样特征、呕吐、体重增加和激惹。不良事件一般为轻至中度。
2022年1月,曙方医药获得vamorolone在大中华区(包括中国内地、香港特别行政区、澳门特别行政区和中国台湾)开发和商业化权益,用于DMD及其他罕见病适应症。
12、默沙东:贝组替凡片
作用机制:HIF-2α抑制剂
适应症:晚期肾细胞癌
贝组替凡(belzutifan)是一种强效和选择性的缺氧诱导因子-2α(HIF-2α)抑制剂,HIF-2α是透明细胞肾细胞癌(ccRCC)中经常积累的转录因子,导致参与癌变的基因组成性激活。2023年12月,FDA批准belzutifan(商品名:Welireg)用于治疗程序性死亡受体1(PD1)或程序性死亡配体1(PD-L1)抑制剂和血管内皮生长因子酪氨酸激酶抑制剂(VEGF TKI)后的晚期肾细胞癌(RCC)患者。
该上市获批是基于一项开放标签,随机试验LITESPARK-005试验,这些患者在接受抗PD-1/PD-L1和VEGF靶向疗法治疗后病情进展,接受贝组替凡120mg每日一次,或依维莫司10 mg每日口服一次。结构显示:在贝组替凡组中,观察到的总缓解率(ORR)为22.7%,而依维莫司组为3.5%。在18个月时,贝组替凡和依维莫司的总生存率(OS)分别为55.2%和50.6%。接受贝组替凡治疗的患者中有3.5%出现完全缓解,而接受依维莫司治疗的患者则没有出现完全缓解。两组的中位缓解时间相似,分别为3.7个月和3.8个月,但贝组替凡的中位缓解持续时间更长,为19.5个月,而依维莫司为13.7个月。
二、抗体
1、辉瑞:Elranatamab注射液
作用机制:靶向BCMA/CD3双抗
适应症:复发或难治性多发性骨髓瘤
Elranatamab(PF-06863135)是一种靶向BCMA和CD3双特异性抗体,2023年8月获美国FDA加速批准用于RRMM。Elranatamab对BCMA和CD3的结合亲和力得到了优化,使T细胞介导的抗骨髓瘤活性更强。皮下注射的目的则是允许使用比静脉注射更高的剂量,而不会增加不良事件。
此前,Elranatamab获美FDA批准是基于II期临床试验MagnetisMM-3的积极结果:(1)试验队列A(n=123)的数据显示,在接受Elranatamab作为首次BCMA靶向治疗的重度预处理的复发或难治性多发性骨髓瘤患者中产生了有临床意义的反应。(2)在既往接受过4线或更多治疗线数的患者(n=97)中,总体客观缓解率(ORR)为58%,大约82%的患者保持了至少9个月的持续缓解。(3)队列B(n=64)的数据显示,在63例接受了至少4条既往治疗方案的患者中,ORR为33%,大约84%的患者保持了至少9个月的持续缓解。
根据2023 EHA公布的长期疗效数据,客观缓解率为61%,35.0%的患者达到了完全缓解(CR)或更好(≥CR),56.1%的患者达到了非常好的部分缓解(VGPR)或更好。当中位随访时间为14.7个月时,中位缓解持续时间(DOR)、总生存期(OS)和无进展生存期(PFS)尚未达到。对于有反应的患者,约72%的患者在15个月时持续缓解。
在安全性方面,常见的不良事件包括:感染、细胞因子释放综合征(CRS)、贫血和中性粒细胞减少。
2、强生:塔奎妥单抗注射液
作用机制:靶向CD3/GPRC5D双抗
适应症:血液肿瘤
塔奎妥单抗(Talquetamab)是一种CD3/GPRC5D双特异性T细胞结合抗体,可与T细胞表面的CD3受体和多发性骨髓瘤细胞、非恶性浆细胞和健康组织(如皮肤和舌头角质化组织中的上皮细胞)表面表达的G蛋白偶联受体C类5成员D(GPRC5D)结合;也就是说,塔奎妥单抗通过吸引T细胞来靶向表达GPRC5D的血液癌细胞。该药物根据病人的体重来给药的,这使得临床医生能够针对患者定制剂量,提高药物的有效性和安全性。2023年8月,塔奎妥单抗获FDA加速批准,用于既往接受过至少4种以上前期疗法(包括蛋白酶体抑制剂、免疫调节剂和抗CD38抗体)的复发性或难治性多发性骨髓瘤成人患者的治疗。
上述获批是基于MonumenTAL-1的1/2期临床研究的积极结果,研究结果显示,接受皮下注射0.8mg/kg(每两周一次)剂量塔奎妥单抗治疗的患者客观缓解率为73.6%,58%的患者得到了非常好的部分缓解,33%的患者得到完全缓解;接受剂量0.4 mg/kg(每周一次)治疗的患者客观缓解率为73.0%,57%患者得到了非常好的部分缓解,35%的患者得到完全缓解。
3、第一三共/阿斯利康:注射用德达博妥单抗
作用机制:靶向TROP2 ADC
适应症:乳腺癌
德达博妥单抗(datopotamab deruxtecan,Dato-DXd)采用第一三共独有的DXd-ADC技术设计,抗体部分由人源化抗TROP2 IgG1单克隆抗体(与Sapporo Medical University合作开发)通过可裂解四肽连接子与多个拓扑异构酶I抑制剂有效载荷(一种依喜替康衍生物,DXd)连接组成。
本次新药上市许可申请是基于关键性III期临床研究TROPION-Breast 01的数据,用于治疗既往在不可切除或转移性疾病阶段接受过系统治疗的激素体(HR)阳性、人表皮生长因子受体2(HER2)阴性(IHC 0、IHC 1+或IHC 2+/ISH-)的不可切除或转移性乳腺癌成人患者。结果显示:在主要终点无进展生存期(PFS)方面,经盲态独立中心影像(BICR)评估,与研究者所选化疗(ICC)相比,德达博妥单抗用于内分泌经治的HR阳性、HER2阴性(IHC0,IHC1+或IHC2+/IHC-)转移性乳腺癌患者,可将疾病进展或死亡风险显著降低37%。在安全性方面,药物整体安全性良好,未发现新的安全性问题,德达博妥单抗组3级或以上治疗相关不良事件的发生率为21%,仅为化疗组的一半(化疗组为45%)。
4、强生:古塞奇尤单抗注射液
作用机制:IL-23单抗
适应症:自身免疫性疾病
古塞奇尤单抗是全球首个获批的白介素23(IL-23)抑制剂,可通过与IL-23的p19亚基结合,可以靶向阻断IL-23这种在自身免疫性疾病中起到关键性作用的细胞因子。古塞奇尤单抗已先后在美国和中国获批中重度斑块状银屑病成人患者,目前其也积极拓展其他适应症,在其他国家已获批多个适应症,包括掌跖脓疱病、银屑病关节炎等。本次申报的静脉注射剂是一种改良的制剂类型。
5、先声药业:注射用苏维西塔单抗
作用机制:VEGF单抗
适应症:实体瘤
苏维西塔单抗(suvemcitug,曾用名:赛伐珠单抗)是新一代重组人源化抗血管内皮生长因子(VEGF)单克隆抗体,是先声药业与美国Apexigen公司合作开发的创新药,在分子结构设计上,苏维西塔单抗采用更高特异性和亲和力的兔抗。临床前研究数据表明,在多个肿瘤模型中,同剂量下苏维西塔单抗比贝伐珠单抗表现出更优抑瘤效果和相似毒性;而在临床试验设计中,苏维西塔单抗剂量仅为贝伐珠单抗的1/7,意味着若临床试验能够成功,苏维西塔单抗相较贝伐珠单抗可能具有疗效和成本双重优势。
2024年1月,公司宣布苏维西塔单抗联合化疗对比安慰剂联合化疗,用于含铂化疗方案治疗失败的复发性上皮卵巢癌、输卵管癌和原发性腹膜癌患者的Ⅲ期临床试验(SCORES研究)已达到主要研究终点。SCORES研究是一项多中心、随机、双盲、安慰剂对照的Ⅲ期临床试验,结果显示:(1)研究达到基于盲态独立影像评估委员会(BIRC)依据RECIST 1.1标准评估的PFS研究主要终点。对比安慰剂联合化疗组,苏维西塔单抗组PFS显示出具有统计学意义和临床意义的改善,且在所有亚组均显示出PFS临床获益的一致性。研究者评估的试验组PFS获益与BIRC评估获益相当;(2)关键次要终点OS的数据尚未成熟,但苏维西塔单抗组显示出获益的趋势。(3)安全性方面,药物安全性可控,未发现新的安全性信号。
三、多肽
信达生物:玛仕度肽注射液
作用机制:GLP-1R/GCGR双重激动剂
适应症:减重、降糖
玛仕度肽(IBI362)是一款胰高血糖素样肽-1受体(GLP-1R)/胰高血糖素受体(GCGR)双重激动剂,除了GLP-1R激动剂具有的促进胰岛素分泌、降低血糖和减轻体重等作用外,还可能通过GCGR的激活具有增加能量消耗和改善肝脏脂肪代谢等效应,预计可以改善葡萄糖耐量并减重。该药物开发的6mg/9mg剂型针对不同体重人群的减重需求,具备成为BIC的国内“重磅炸弹”的潜质,在减重、代谢获益“六项全能”。作为一种胃泌酸调节素创新化合物(OXM3),玛仕度肽利用脂肪酰基侧链延长作用时间,允许每周给药一次。
2023年12月,信达生物启动了针对玛仕度肽的III期临床试验,用于在经单纯饮食运动干预伴/不伴二甲双胍单药治疗血糖、体重控制不佳的中国早期2型糖尿病合并肥胖受试者中,评估IBI362和司美格鲁肽的疗效和安全性。目前,玛仕度肽在中国超重或肥胖(GLORY-1和GLORY-2)受试者和2型糖尿病(DREAMS-1和DREAMS-2)受试者中的四项III期注册研究正在进行中。
2024年1月,公司宣布GLORY-1达成主要终点和所有关键次要终点,研究入组610例受试者,随机分配至玛仕度肽4 mg组、玛仕度肽6 mg组或安慰剂组,双盲治疗48周。研究结果显示,(1)玛仕度肽4 mg和6 mg组受试者治疗32周后体重相对基线的百分比变化,以及体重相对基线下降≥5%的受试者比例均显著优于安慰剂组;第48周时,玛仕度肽组的减重疗效较32周进一步提升,两个主要研究终点均顺利达成。(2)此外,该研究所有关键次要终点均顺利达成,包括与安慰剂相比,玛仕度肽组体重相对基线下降≥10%和≥15%的受试者比例、以及腰围、收缩压、甘油三酯、低密度脂蛋白胆固醇、总胆固醇、血尿酸和丙氨酸氨基转移酶水平相对基线的变化;玛仕度肽对以上体重和心血管代谢指标的改善均显著优于安慰剂。(3)双盲治疗期内,玛仕度肽整体安全性良好,安全性特征与玛仕度肽的既往临床研究一致,未发现新的安全性信号。
四、生长激素类
1、特宝生物:怡培生长激素注射液
作用机制:——
适应症:儿童生长激素缺乏症
1月11日,特宝生物的怡培生长激素注射液的的上市申请获CDE受理。怡培生长激素(YPEG-rhGH)采用40kD Y型分支聚乙二醇(YPEG)分子对人生长激素(rhGH)进行单分子修饰,优选高生物学活性、非N-末端位点为主的修饰组分,在保证疗效的同时,旨在降低给药剂量,获得更佳的长期药物安全性。II/III期研究显示,儿童生长激素缺乏症(GHD)患者接受12周的治疗后,使用怡培生长激素100、120、140μg/kg/周组和重组人生长激素35μg/kg/天组(对照组)的身高增长速度分别为7.07、10.39、12.27厘米/年和11.58厘米/年。
2、维昇/Ascendis:注射用隆培促生长素
作用机制:长效生长激素类似物
适应症:儿童生长激素缺乏症
3月8日,维昇/Ascendis的注射用隆培促生长素的上市许可申请(BLA)获CDE受理。隆培促生长素是首个在美国及欧洲获批上市的长效生长激素,用于治疗儿童生长激素缺乏症,在大中华区以外的全球临床开发由Ascendis Pharma负责。该药物的作用机制有别于其它技术的长效生长激素类似物,每周一次给药后,隆培促生长素可以实现在体内以可控的方式缓慢释放未经修饰的人生长激素,其释放出的生长激素与人体分泌的内源性生长激素结构一致,且生物活性、作用机制和生理分布均与目前广泛使用的生长激素日制剂相同,确保了隆培促生长素的安全性及有效性。
2022年11月,维昇药业首次对外公布了隆培促生长素针对中国生长激素缺乏症(GHD)儿童患者开展的3期关键临床试验的主要研究数据。研究结果表明,隆培促生长素或生长激素日制剂治疗52周后,年化生长速率(AHV)分别为10.66厘米/年和9.75厘米/年(组间差异0.91,95%置信区间:0.37~1.45,p=0.0010),达成研究主要终点,即隆培促生长素非劣于生长激素日制剂。此外,根据预设的统计检验,主要终点的分析结果也证实隆培促生长素优于生长激素日制剂。多个预设的敏感性分析证实了结果的稳健性。安全性结果显示隆培促生长素耐受性良好,安全性特征与生长激素日制剂相当。