原发性胆汁性胆管炎(PBC)是一种罕见的自身免疫性肝脏疾病,目前全球获批治疗PBC的药物非常有限,仅有3款药物。
有限的治疗选择下,存在巨大的未满足的临床需求。
Coherent Market Insights报告显示,2017年全球PBC治疗市场规模为5.26亿美元,未来10年复合增长率将保持在36.3%,预计2026年将达到85.93亿美元。
百亿美元市场待爆发,谁将成为全球第四款PBC药物?
获批药物仅3款
PBC的进展与增加的肝相关死亡风险相关,目前其发病机制尚不明确,可能与遗传因素及其与环境因素相互作用所导致的免疫紊乱有关。
目前,全球获批治疗PBC的药物非常有限。其中熊去氧胆酸(UDCA)是全球公认的PBC一线治疗药物,具有改善患者生化指标、缓解病理改变和延缓病程进展的作用,但约40%的患者对UDCA治疗应答不佳。
Ocaliva(奥贝胆酸)于2016年5月被FDA批准单药治疗无法耐受UDCA的成人PBC,或联合UDCA治疗UDCA疗效不佳的成人PBC。奥贝胆酸是一种法尼醇X受体(FXR)激动剂,其可以诱导肝细胞合成和分泌更多的胆汁酸,并抑制肝细胞合成甘油三酯,从而保护肝脏,减轻肝脏炎症、坏死和纤维化的进程。不过,Ocaliva治疗会导致患者的瘙痒症发生率增加,并引起低密度脂蛋白胆固醇水平升高。
Iqirvo(elafibranor)是近期获批的一款PBC新药,它是一种每日1次口服的过氧化物酶体增生激活受体(PPAR)激动剂,被FDA批准联合UDCA用于治疗对UDCA应答不足的成人PBC,或单药治疗对UDCA不耐受的PBC患者。
Ocaliva和Iqirvo这两款药物的适应症人群相同,均可降低PBC患者的血清碱性磷酸酶水平。值得注意的是,Ocaliva是全球首个获批的PBC二线疗法,业界非常看好该药,evaluate Pharma曾预测其2020年销售额有望达到30亿美元,事实上,2020年其销售额为3.13亿美元。
Seladelpar即将撞线
目前全球还有多款在研PBC新疗法,详见下表。这些在研PBC疗法作用靶点相对集中,主要包括PPAR、FXR。其中setanaxib作用靶点比较新颖,它是一种NOX4和NOX1抑制剂,具有抗炎和抗纤维化作用,曾被FDA授予治疗PBC的孤儿药资格认定。
我国药企也积极布局PBC领域,不过在研药物最快处于2期临床,而且其中有些药物作用靶点未知,且药物类型不局限于小分子药物,如TB001是作用靶点未知的双靶点多肽药物。
表1全球部分在研PBC药物
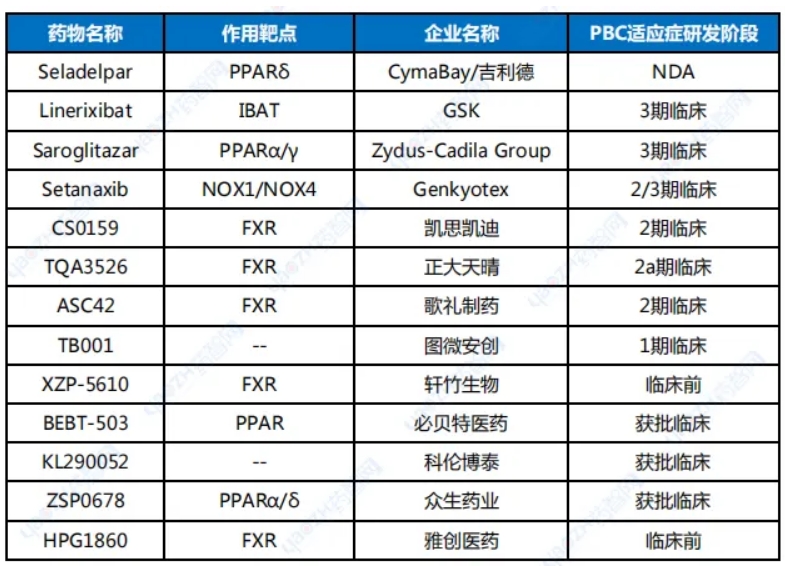
资料来源:公开资料整理
Seladelpar:正接受FDA优先审查
Seladelpar是一款口服强效选择性PPARδ激动剂,临床前和临床数据显示其具有参与调节胆汁酸合成、炎症、纤维化和脂质代谢、储存和运输基因的能力。目前,该药治疗PBC的新药申请正在美国接受优先审查,PDUFA日期为2024年8月14日。
已公布的Seladelpar在对UDCA反应不足或不耐受的PBC患者中开展的全球3期临床试验RESPONSE的数据显示:seladelpar 10 mg组和5 mg组治疗组分别有78.2%和57.1%的患者达到复合终点,而安慰剂组仅有12.5%达到复合终点;5 mg和10 mg seladelpar治疗组中碱性磷酸酶(ALP)恢复正常的比例分别为5.4%(p=0.08)和27.3%(p<0.0001),而接受安慰剂治疗的患者中ALP恢复正常的比例为0%;与安慰剂相比,中度至重度瘙痒(NRS≥4)患者中10 mg seladelpar对瘙痒的改善具有统计学意义(p<0.02);与安慰剂组相比,seladelpar组丙氨酸转氨酶显著降低(5 mg:23.4%;10 mg:16.7%;安慰剂:4%)。
此外,Seladelpar在PBC患者中开展的开放性扩展研究ASSURE也已取得积极结果。数据显示:10mg Seladelpar治疗组中70.3%的患者达到了具有临床意义的综合反应终点,37.2%的患者在12个月后达到了ALP正常化。此外,Seladelpar治疗还会显著降低PBC患者的谷氨酰转肽酶(GGT)、丙氨酸转氨酶(ALT)和总胆红素(TB)水平,分别降低36.4%、25.2%和9.2%。
值得一提的是,Seladelpar由CymaBay开发,今年2月,吉利德通过斥资43亿美元收购CymaBay将Seladelpar纳入囊中。而吉利德之所以如此大手笔,正是看中了Seladelpar的潜力。CymaBay在与吉利德的沟通中给出了seladelpar明确的销售预期,2037年将实现23.94亿美元的最高峰值。
Linerixibat:缓解PBC瘙痒症状
Linerixibat是一种口服小分子回肠胆汁酸转运体(IBAT)抑制剂,其通过阻断小肠中胆汁酸的吸收,减少循环中瘙痒性胆汁酸,从而达到缓解瘙痒的目的。已公布的一项多中心、随机、平行组2期临床试验结果显示:Linearixibat可减轻胆汁淤积性瘙痒,且未发生严重不良事件。
CS0159和ASC42:PBC适应症已进入2期临床
CS0159是一种基于晶体结构辅助设计获得的新型强效非甾体类FXR小分子激动剂,被开发用于治疗PBC、PSC(原发性硬化性胆管炎)和NASH(非酒精性脂肪性肝炎)。系统的临床前研究表明,CS0159具有强效的FXR激动活性及肝靶向分布的特点,可明显改善NASH小鼠模型的病理状况,具有起效剂量低、药效显著且耐受性良好的特点。目前,该药治疗PBC的临床试验已进入2期阶段。
ASC42是歌礼制药自主研发的一款新型高效选择性非甾类FXR激动剂。美国开展的1期临床试验数据显示:在人体有效剂量15 mg、每日一次、为期14天的治疗过程中,未观察到瘙痒症状,而且FXR靶向激活的生物标志物成纤维细胞生长因子19(FGF19)在给药第14天时的增幅高达1780%。同时,LDL-C均值在治疗期间维持正常水平。2023年7月,ASC42治疗PBC的2期临床试验完成患者入组。
结语
作为一种罕见肝病,PBC治疗虽取得一些可喜进展,但整体来看该市场并未饱和,获批药物数量也很有限。
庆幸的是,目前国内外还有多款在研PBC新药,其中Seladelpar正在美国接受优先审查,预计很快就会和近来获批的elafibranor同台打擂。
期待PBC治疗领域早日有新成员入局,为PBC患者提供更多选择。
参考资料:
1.《原发性胆汁性胆管炎治疗药物临床研发进展》.凡默谷.2023-07-01
2.《APASL名家讲堂丨贾继东教授:原发性胆汁性胆管炎最新进展》.国际肝病.2023-02-26